دو هفتهنامهی ساینسنیوز در شمارهی ۲۱ ژانویهی ۲۰۱۷ مقالهای به نام «Better Batteries Charge Forward» منتشر کرده است. این مقاله به فناوریهایی در ساخت باتریها اشاره کرده که اکنون در مرحلهی توسعه قرار دارند و به نظر میرسد که در آیندهای نزدیک بعضی از آنها بتوانند به طور کامل تجاریسازی شوند. فناوریهایی که برای ایجاد تحول در زندگی جامعهی بشری و هدایت او به سوی آیندهی وابسته به الکتریسیته ضروری هستند. در ادامه میتوانید ترجمهی این مقاله را تحت عنوان «باتریهایی برای آینده؛ چگونه فناوری ذخیرهی انرژی دگرگون میشود؟» بخوانید.
شارژدهی طولانیمدت باتری دستگاههای الکترونیکی آرزوی همهی ماست. باتری گوشیهای همراه و لپتاپهای ما تقریبا هر شب باید شارژ شوند. کسانی که صاحب خودروی برقی هستند باید حسابی حواسشان جمع باشد که به موقع آن را شارژ کنند و با باتری خالی وسط جاده گرفتار نشوند. ما در خانه برای هرکدام از دستگاههایمان یک شارژر مجزا داریم. گاهی اوقات شارژ شبانهی همهی آنها باعث میشود که آرزو کنیم ای کاش باتریهای ما میتوانستند هفتهها و ماهها شارژ داشته باشند.
پژوهشگرانی که در زمینهی بهبود عملکرد باتریها کار میکنند معمولا کمتر به فکر گجتهای الکترونیکی روزمرهی ما هستند. آنها خیلی کلانتر به قضیه نگاه میکنند و در این اندیشهاند که روزی بتوانیم به کمک باتریهای ارزان و پرظرفیت از شَر سوختهای فسیلی خلاص شویم. با باتریهای پرظرفیت قدرمندی که خیلی زود شارژ میشوند میتوانیم خودروها و کامیونهای بنزینی و گازوییلی را کنار بگذاریم و به سراغ وسایل نقلیهی برقی برویم. وسایل نقلیهای که نه آلودگی هوا تولید میکنند و نه آلودگی صوتی. حتی هواپیماها هم میتوانند برقی شوند. اگر بتوانیم باتریهای ایدهآل خود را بسازیم، با خیال راحت استفاده از انرژی خورشیدی و بادی را گسترش میدهیم چرا که مطمئنیم وقتی آفتاب نمیتابد یا باد با قدرت کافی نمیوزد هم انرژی ذخیره شدهی کافی برای تامین نیاز خانههایمان داریم.

پژوهشگران امیدوارند با رسیدن به فناوریهای نوین در ساخت باتری بتوانند آیندهای کاملا وابسته به برق برای تمدن انسان رقم بزنند.
اختراع یک باتری بهتر میتواند باعث جهشی بزرگ در فناوری و البته رشد سریع جامعه شود. درست مثل همان جهشی که باتریهای لیتیوم-یون ایجاد کردند. باتریهای لیتیوم-یون از اوایل دههی ۱۹۹۰ مرسوم شدند و تقریبا دو برابر بهترین باتریهای زمان خود ظرفیت داشتند. آنها توانستند فناوری ارتباطات و نحوهی تعامل مردم با یکدیگر را متحول کنند.
«جورج کِرَبتری» (George Crabtree) که یک دانشمند علم مواد و مدیر مرکز مشترک پژوهش در زمینهی ذخیرهی انرژی در آزمایشگاه ملی آرگون در ایلینوی است میگوید: «کاری که باتریهای لیتیوم-یون با دستگاههای الکترونیکی شخصی انجام دادند یک تحول بود.» او که پژوهش در زمینهی باتریها در دهها دانشگاه آمریکا را هماهنگ میکند، ادامه ميدهد: «گوشیهای همراه (به لطف باتریهای لیتیوم-یون) نه تنها تلفنهای خانگی را برای بسیاری منسوخ کردند بلکه دوربینها و اینترنت را به دست میلیونها نفر رساندند.» این جهش بزرگ یک شبه رخ نداد و «نتیجهی دههها کار و گامهای متعدد رو به جلو بود.»
باتریهای لیتیوم-یون به خصوص برای استفاده در شبکهی برق و وسایل نقلیهی برقی محدودیتهای خاص خودشان را دارند. خوشبختانه پژوهشگران دست از تلاش بر نمیدارند. طی ۱۰ سال گذشته، دانشگاهها، شرکتهای فناوری و تولیدکنندگان خودرو صدها فناوری جدید در باتریها بوجود آوردهاند که باعث شده بتوانیم امیدوار باشیم نسل آیندهی باتریها انرژی بیشتری ذخیره بکنند، بیشتر شارژ بدهند، آسانتر شارژ شوند و ارزانتر و ایمنتر باشند.

وسایل نقلیهی برقی و ذخیرهی انرژی در شبکههای برق از جمله مهمترین انگیزهها برای پژوهشگران در پیشرفت فناوری باتریها هستند.
به نظر میرسد که در شُرف رسیدن به نتیجهی پیشرفتهای گام به گام کوچک یک دههی گذشته هستیم. اواخر سال ۲۰۱۷ دانشمندان از مدلهای اولیه و آزمایشی باتریهایی رونمایی میکنند که احتمالا میتوانند تجاریسازی شده و روی خط تولید بروند. بعضی از آنها دارای مواد سازندهی جدید مثل سولفور و منیزیوم هستند. عناصری که باعث میشوند باتری بتواند انرژی را خیلی بهینهتر ذخیره کند و شارژدهی بیشتری داشته باشد. بعضی دیگر هم طراحی کاملا جدید و انقلابی دارند.
کِرَبتری میگوید: «این مدلهای اولیه، باتریهایی برای اثبات اصول [جدید ساخت باتری] هستند، نسخههایی مینیاتوری که کار میکنند.» تولید انبوه و تجاری این باتریها بین پنج تا ۱۰ سال زمان میبرد. کِرَبتری میگوید که ایجاد جهش در فناوری باتریها به طرز عجیبی مشکل است.
نیروگاههای کوچک برق
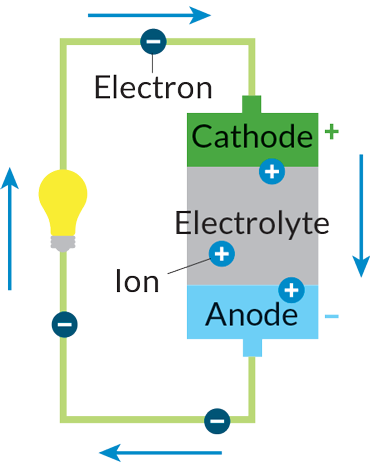
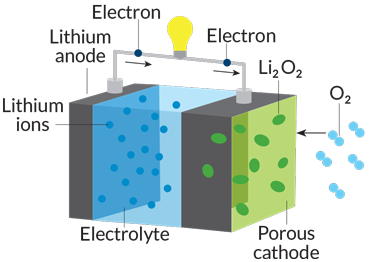
باتریها در حقیقت نیروگاههای شیمیایی کوچک برق هستند. از نظر فنی، یک باتری مجموعهای از دو یا تعداد بیشتری «سلول الکتروشیمیایی» است. انرژی آزاد شده از واکنشهای شیمیایی جریانی از الکترونها بوجود میآورد. هرچه انرژی تولید شده توسط واکنشهای شیمیایی بیشتر باشد، شار الکترونها هم بیشتر خواهد بود. جریان الکترونها انرژی مورد نیاز دستگاه مورد نظر، از ساعت دیواری گرفته تا زنگ هشدار آتشسوزی ساختمان یا موتور یک خودروی برقی را فراهم میکند.
برای اینکه یک باتری بتواند دستگاهی برقی را به کار بیندازد، الکترونها باید از طریق مداری که دو الکترود را به هم وصل میکند به جریان بیفتند. این الکترودها با نام آند و کاتد شناخته میشوند و بینشان مادهای به نام الکترولیت قرار دارد. در آند، واکنشهای شیمیایی اکسایش باعث آزاد شدن الکترونها میشود. در کاتد، الکترونها وارد واکنشهای کاهش میشوند. الکترولیت کاری میکند که یونهای تولید شده در واکنشهای اکسایش-کاهش بتوانند بین دو الکترود رفت و آمد کنند و در نتیجه مدار کامل شود.
اصول اولیهی باتری
باتریها دارای سه جزء تشکیل دهنده اصلی هستند. دو الکترود (الکترود منفی به نام آند و الکترود مثبت به نام کاتد) و مادهی الکترولیت که کمک میکند یونها بتوانند در باتری جابجا شوند. واکنشهای شیمیایی در آند باعث آزاد شدن الکترونها میشوند. الکترونهای آزاد شده در گذر از مدار خارجی میتوانند یک لامپ یا دستگاه دیگر را به کار بیندازند.
بسته به اینکه در ساخت الکترودها و الکترولیت از چه موادی استفاده شده، میتوان باتریهایی ساخت که با اعمال جریان الکتریکی، واکنشهای شیمیایی در آنها به صورت عکس صورت بگیرد و بدین ترتیب شارژ شوند. پژوهشگرانی که در زمینهی ساخت مواد لازم برای معجون الکتروشیمیایی باتریهای قابل شارژ کار میکنند باید حواسشان جمع باشد که واکنشهای ثانویه کار را خراب نکنند.
کِرَبتری میگوید: «آن واکنش شیمیایی که میخواهید وجود دارد. همانی که انرژی را ذخیره و آزاد میکند.» او ادامه میدهد: «ولی یک دوجین واکنش دیگر هم رخ میدهد.» این واکنشهای ثانویه میتوانند باتری را از کار بیندازند یا بدتر، منجر به یک فاجعه شوند. (چیزی مثل فاجعهی سامسونگ گلکسی نوت ۷)
اولین مدلهای باتریهای لیتیوم-یون در دههی ۱۹۷۰ ساخته شدند و آند آنها از لیتیوم خالص درست شده بود. در استفادهی طولانی مدت، یونهای لیتیوم از آند جدا میشدند و مثل یک زائده روی آن تجمع پیدا میکردند. طول این زائده به تدریج آنقدر زیاد میشد که به کاتد میرسید و باتری از درون دچار اتصال کوتاه میشد. در آند باتریهای لیتیوم-یون امروزی گرافیت به کار رفته است و بنابراین یونهای لیتیوم آزاد شده، بین لایههای اتمهای کربن جمع میشوند.
باتریهای لیتیوم-یون از ابتدا با هدف استفاده در وسایل الکترونیکی کوچک ساخته شدند. یعنی کسی به فکر طراحی باتريهای لیتیوم-یون برای استفاده در خودروهای برقی یا ذخیرهی انرژی در شبکههای برق نبود. خودروهای برقی به انرژی الکتریکی زیادی احتیاج دارند و هنگام حرکت اولیه هم انرژی زیادی باید به موتور آنها وارد شود. اکنون در خودروهای برقی از هزاران باتری لیتیوم-یون کوچک استفاده میشود که به طور متوسط میتواند انرژی آنها برای طی مسیری در حدود ۳۲۰ کیلومتر را تامین کند. مشخص است که این میزان خیلی کمتر از مسافتی است که خودروهای بنزینی در هر بار پر شدن باک میتوانند طی کنند. بعلاوه شارژ باتریهای لیتیوم-یون معمولا آنقدر سریع تمام میشود که نمیتوانند برای ساعتهای طولانی شبکههای برق بزرگ را تغذیه کنند.

باتریهای لیتیوم-یون ابتدا با هدف استفاده در وسایل الکترونیکی کوچک ساخته شدند و کسی به فکر استفاده از آنها در خودروها نبود.
به عقیدهی کِرَبتری، راهحل این مشکلات گنجاندن تعداد بیشتر باتری در خودروهای برقی یا شبکههای برق نیست. مجتمع کردن باتریها زمان شارژ شدن را کاهش نمیدهد و عمر آنها را هم زیاد نمیکند؛ تازه بر وزن کل منبع تغذیه هم میافزاید. مثلا در مورد خودروهای برقی، سازنده نمیتواند کل فضاهای موجود در بدنهی خودرو را با باتری پر کند. برای اینکه خودروهای برقی توانایی رقابت با خودروهای مجهز به موتور احتراق داخلی را داشته باشند، باید باتریهایی ارزان و پرتوان ساخته شود که میتوانند دستکم تا ۱۵ سال عمر کنند. قضیه دربارهی باتریهای لازم برای استفاده در شبکههای برق که مسئولیت ذخیرهی انرژی برای مواقع اضطراری را بر عهده میگیرند هم به همین صورت است. آنها باید خیلی ارزان باشند و چند ده سال دوام بیاورند.
«یِت مینگ چیانگ» (Yet-Ming Chiang) که یک دانشمند علم مواد در دانشگاه MIT است میگوید: «هیچ نوع باتری وجود ندارد که بتواند همهی نیازهای شما را برآورده کند.» باتریهایی که در دستگاههای همراه به کار میروند با آنهایی که باید در حمل و نقل و شبکهی برق استفاده شوند خیلی متفاوت هستند. باید انتظار انواع گوناگونی از باتری را داشته باشیم که هرکدام برای کاربردی متفاوت ساخته شدهاند.
استفاده از سولفور
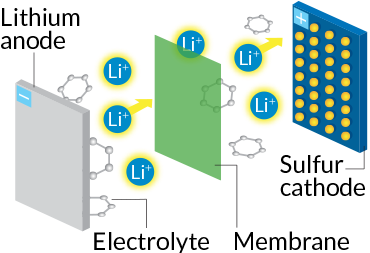
باتریهای لیتیوم-سولفور امید بعدی ما برای استفاده در خودروهای برقی هستند. در این باتریها، بیشتر کاتد از سولفور ساخته شده است. سولفور یک پسماند صنعتی ارزان و فراوان است که به محیطزیست ضرر نمیرساند. آند این باتريها هم از لیتیوم ساخته میشود. یونهای لیتیوم به هنگام تخلیهی شارژ باتری از آند جدا میشوند و از طریق الکترولیت مایع به کاتد سولفوری میرسند. آنجا یونهای لیتیوم با اتمهای سولفور پیوند کوالانسی ایجاد میکنند. هرکدام از اتمهای سولفور به جای یک یون لیتیوم به دو یون لیتیوم متصل میشود و در نتیجه تعداد پیوندها در کاتد دوبرابر میشود. پیوند شیمیایی بیشتر، به معنی ذخیرهی بیشتر انرژی است و در نتیجه باتریهای لیتیوم-سولفور بیشتر از باتریهای لیتیوم-یون ظرفیت دارند. در ضمن از آنجا که سولفور سبکوزن است، تولیدکنندگان میتوانند به ازای هر گرم، پنجبرابر انرژی بیشتری ذخیره کنند. در کل باتریهای لیتیوم-سولفور میتوانند خیلی سبکتر ساخته شوند.
نوع باتری: لیتیوم-سولفور
چگونگی کارکرد: یونهای لیتیوم از آند با سولفور در کاتد وارد برهمکنش میشوند تا جریان الکتریکی بوجود آید.
مورد استفاده: خودروها، گوشیهای همراه، لپتاپها
مزایا: سولفور ارزان و خیلی سبک است. امکان ساخت باتریهای سبکتر با ظرفیت بیشتر.
موانع: نسخههای کنونی عمر کمی دارند و باید روی مادهی الکترولیت آنها کار شود. الکترولیتهای کنونی کاتد را حل میکنند و با آند واکنش میدهند.
اگر در خودروهای برقی از باتریهای لیتیوم-سولفور استفاده کنیم میتوانیم بُرد آنها را به ۸۰۰ کیلومتر افزایش دهیم. البته پژوهشگران اول باید از پس مشکل عمر کوتاه این باتریها بر بیایند. مشکلی که طبق گفتهی کِرَبتری بر اثر از بین رفتن لیتیوم و سولفور در هر بار شارژ و تخلیهی شارژ بوجود میآید.
وقتی لیتیوم با سولفور ترکیب میشود، ترکیبی به نام پلیسولفید بوجود میآید که خیلی سریع فضای داخلی باتری را پر میکند. پلیسولفیدها به هنگام تخلیهی شارژ باتری روی کاتد تشکیل میشوند. وقتی این ترکیبات در الکترولیت مایع باتری حل میشوند، به سوی آند میروند و با آن واکنش میدهند. در نتیجهی این واکنش فیلمی بوجود میآید که طی چند دهبار شارژ و تخلیهی شارژ باتری یعنی تقریبا یکی دو ماه استفاده، آن را بلااستفاده میکند.
گروهی به رهبری «کوین زاوادیل» (Kevin Zavadil) در آزمایشگاههای ملی ساندیا درحال تلاش برای جلوگیری از تشکیل پلیسولفیدها در الکترولیت هستند. الکترولیت حاوی نمک و یک حلال است. باتریهای لیتیوم-سولفور کنونی برای اینکه طول عمر متوسط داشته باشند نیاز به الکترولیتی با حجم خیلی زیاد دارند. زاوادیل و گروهش میخواهند الکترولیتی بسازند که سولفور را کمتر در خود حل کند و میزان تشکیل پلیسولفید را هم به حداقل برساند.
آنطور که در شمارهی ۹ سپتامبر ۲۰۱۶ مجلهی ACS Energy Letters منتشر شده، الکترولیت جدید دارای نمک بیشتر و میزان ناچیزی حلال است. پژوهشگران همچنین توانستهاند حجم کلی الکترولیت را در باتری کم کنند. زاوادیل میگوید که در عمل این روش توانست میزان تشکیل پلیسولفیدها را چند برابر کم کند.
زاوادیل میگوید: «ما ایدههایی دربارهی چگونگی استفاده از غشاها برای حفاظت از سطح لیتیوم در برابر پلیسولفیدها داریم.» هدف این است که تا آخر سال ۲۰۱۷ نمونهای آزمایشی از این باتری بسازند که برای هزاران بار شارژ و تخلیه دوام داشته باشد.
یک مهندس مواد به نام «گیهوآ یو» (Guihua Yu) از دانشگاه آستین در تگزاس با همکارانش در دانشگاه صنعتی چجیانگ هانگژو چین در حال کار کردن روی روشی تازه در ساخت باتریهای لیتیوم-سولفور است. آنها میخواهند کاتد سولفور معمولی را با ساختاری ظریف که سولفور را در آرایهای از نانوتیوبها در بر میگیرد جایگزین کنند. آنطور که در شمارهی نوامبر ۲۰۱۶ نشریهی Nano Letters منتشر شده، نانوتیوبهایی که سولفور را در بر میگیرند از منگنز دیاکسید ساخته شدهاند. مادهای که میتواند پلیسولفیدها را جذب کند و آنها را نگه دارد. نانوتیوبها با پلیپیرول اندود میشوند. پلیپیرول یک پلیمر رسانا است که به افزایش جریان الکترونها کمک میکند.
کاتد ساخته شده از نانوتیوبها برای افزایش عملکرد و طول عمر باتریهای لیتیوم-سولفور مورد استفاده قرار میگیرد. نانوتیوبهای بسیار رسانا مانند آنچه در این عکس نشان داده شده پلیسولفیدهای مشکلساز را به دام میاندازند. پلیسولفیدها محصولات ثانویهی واکنشهای شیمیایی هستند که باتری را به کار میاندازد.
این روش باعث جلوگیری از تجمع پلیسولفید در باتری میشود و در کل بازدهی باتری را افزایش میدهد. اکنون ساختارهای بوجود آمدهی جدید باعث شدهاند باتریهای لیتیوم-سولفور در هر بار شارژ و تخلیهی شارژ کمتر از ۰٫۰۷ ظرفیت خود را از دست بدهند. بعد از ۵۰۰ بار شارژ و تخلیه، باتری ۶۵ درصد از ظرفیت اصلی خود را حفظ کرد. این پیشرفتی بزرگ در فناوری ساخت باتری لیتیوم-سولفور به حساب میآید. البته این مقدار هنوز فاصلهی زیادی تا باتریهایی دارد که میخواهیم در خودروها به کار ببریم و قرار است ۱۰ تا ۱۵ سال و برای هزاران سیکل شارژ و تخلیهی شارژ کار کنند.
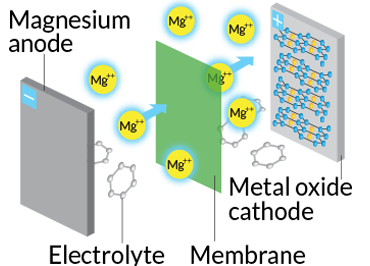
دانشمندان در آزمایشگاه ملی آرگون درحال ساخت نوع دیگری از باتریها هستند. نوعی که به جای بهرهگیری از یونهای لیتیوم در آند از منیزیوم استفاده میکند. یک مهندس مواد در آرگون به نام «براین اینگرام» (Brian Ingram) میگوید که این کار میتواند باعث افزایش چشمگیر توانایی ذخیرهی انرژی شود. یونهای منیزیوم دارای بار ۲+ هستند و این درحالیست که یونهای لیتیوم بار ۱+ دارند. قابلیت منیزیوم در تولید دو برابری جریان الکتریکی نسبت به یونهای لیتیوم میتواند باعث بوجود آمدن باتریهای کوچکتر با امکان ذخیرهی بیشتر انرژي شود.
نوع باتری: منیزیوم-یون
چگونگی کارکرد: درست مثل باتریهای لیتیوم-یون است ولی منیزیوم جایگزین لیتیوم میشود.
مورد استفاده: خودروها، گوشیهای همراه، لپتاپها
مزایا: منیزیوم فراوانی بیشتری نسبت به لیتیوم دارد و دارای دو الکترون است. بنابراین میتواند انرژی بیشتری ذخیره کند.
موانع: شیمی آن هنوز به خوبی شناخته نشده و طول عمر کمی دارد.
البته کار با منیزیوم هم چالشهای خاص خودش را دارد. درحالی که یونهای لیتیوم خیلی سریع از درون الکترولیت گذر میکنند، یونهای منیزیوم حرکت کندی دارند. گروهی از پژوهشگران در دانشگاه شمالغرب آرگون و آزمایشگاه ملی «اوک ریج» (Oak Ridge) پرتوهای پرانرژی ایکس را به منیزیوم درون باتریها تاباندند و متوجه شدند که این حرکت کند به دلیل برهمکنش یونهای منیزیوم با مولکولهای الکترولیت است. اینگرام و گروهش در حال آزمایش مواد جدیدی هستند که بتواند در الکترولیت استفاده شود و از میزان برهمکنش بکاهد. گروه اینگرام تلاش میکند که تا ماه دسامبر امسال مدلهایی پیشتولید با طول عمر زیاد و عمکرد بالا بسازد که خروجی ۳ ولت ارائه میدهند. امروزه خروجی باتریهای لیتیوم-یون معمولی بین ۳٫۸ تا ۴ ولت است.
باتریهای جریانی
دو-سوم مصرف انرژی آمریکا در بخشهای حمل و نقل و شبکهی برق صورت میگیرد. این درحالیست که طبق گفتهی ادارهی اطلاعات انرژی آمریکا، فقط ۱۰ درصد از انرژی شبکهی برق از منابع تجدیدپذیر تامین میشود. اگر قرار باشد انرژی باد و خورشید سهم بیشتری در اختیار بگیرند باید در بخش ذخیرهی انرژی تحولاتی بزرگ ایجاد شود. کِرَبتری میگوید آنچه نیاز داریم باتریهایی است که بتوانند انرژی را برای استفاده در زمانهای مورد نیاز ذخیره کنند. او ادامه میدهد: «هرچند که تابش خورشید در هنگام ظهر بیشتر است ولی ساعت اوج مصرف هنگام غروب و زمانی است که مردم به خانههایشان رفتهاند، چراغها را روشن کردهاند و شام میپزند.»
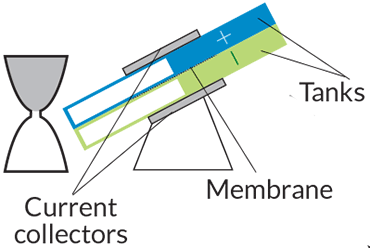
نوع باتری: جریانی
چگونگی کارکرد: دو مخزن مایع که یکی بار مثبت و دیگری بار منفی دارد با یک غشاء از هم جدا شدهاند. جایی که مایع این دو مخزن به هم میرسد، یونها واکنش میدهند و الکترونها جاری میشوند.
مورد استفاده: خودروها، شبکهی برق، باتريهای پشتیبانی
مزایا: جدا کردن دو قسمت باتری باعث میشود که راحتتر بتوانیم باتریهایی با توان بیشتر و وزن سبکتر بسازیم. در بعضی از طراحیهای جدید پمپها حذف شدهاند و از گرانش برای تنظیم جریان انرژی استفاده میشود.
موانع: نسخههای کنونی نمیتوانند به اندازهی باتریهای لیتیوم-یون انرژی ذخیره کنند. نگهداری از پمپها هم پر دردسر است.
برای تامین انرژی الکتریکی در شب یا روزهای ابری و بدون باد به انواع دیگری باتری احتیاج داریم. «باتریهای جریانی» (Flow Batteries) به صورت نظری میتوانند این نیاز را برآورده کنند. باتریهای جریانی به جای الکترودهای جامد از دو مخزن جداگانهی پر از مواد شیمیایی بهره میبرند که یکی بار مثبت و دیگری بار منفی دارد. پمپهایی وجود دارد که این مواد شیمیایی مایع را از مخازن به یک حفرهی مرکزی هدایت میکنند. در این حفرهی مرکزی، مولکولهای موجود در دو مایع وارد واکنشهای انرژیزا میشوند. غشایی که درون حفرهی مرکزی قرار دارد باعث میشود یونهای مثبت و منفی جدا از هم باقی بمانند.
باتریهای جریانی میتوانند انرژی را به مدت طولانی ذخیره و به هنگام نیاز آن را به شبکه تزریق کنند. از آنجا که مایعهای ذخیرهکنندهی انرژی در مخازن خارجی جداگانه نگهداری میشوند احتمال آتشسوزی وجود ندارد و میتوان آنّها را بسته به نوع استفاده در سایز بزرگ یا کوچک ساخت. یعنی اگر میخواهید انرژی بیشتری ذخیره کنید کافیست مخازن بزرگتری بسازید.
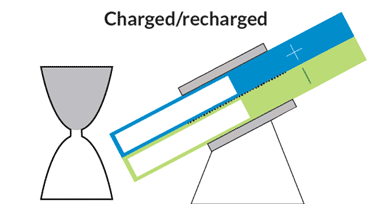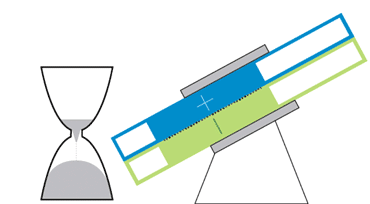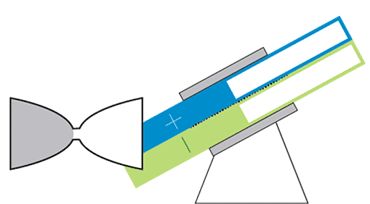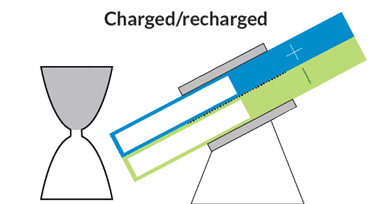
باتری الاکلنگی
این باتری جریانی، حرکتی الاکلنگی دارد و بدین معناست که برای کار انداختن آن نیازی به پمپهای گرانقیمت نیست. یک موتور الکتریکی حرکت الاکلنگی ایجاد میکند و بنابراین مایع درون مخازن میتواند به حفرهی مرکزی بیاید تا جریان الکتریکی ایجاد شود. با تنظیم زاویه میتوان سرعت حرکت مایع را کم و زیاد و یا آن را متوقف کرد.
البته فعلا ساخت و نگهداری از باتریهای جریانی گران است و برای استفاده به عنوان بکآپ شبکههای برق محدودیتهای زیادی دارند. باتریهای جریانی امروزی دارای فلزات نادر و سمی مثل وانادیوم هستند. در ضمن قطعات متحرک زیادی دارند و احتمال بروز مشکل یا نشتی در مخازن، پمپها، مهر و مومها و سنسورها زیاد است.
در دانشگاه MIT، چیانگ و همکارانش درحال رفع این مشکلات هستند. یکی از آنها نوعی باتری جریانی به شکل ساعت شنی است که پمپهای گرانقیمت و پردردسر در آن استفاده نشده. حفرهی مرکزی که واکنشهای شیمیایی در آن رخ میدهد در میان دو مخزن قرار گرفته است. گرانش باعث جاری شدن مایع از درون مخازن به حفرهی مرکزی میشود؛ درست مثل اتفاقی که برای شنها در ساعت شنی میافتد. یک موتور الکتریکی زاویهی باتری را تنظیم میکند تا سرعت جریان کم و زیاد شود.
چیانگ میگوید که این طرح درست مثل طرح یک خودروی مفهومی است. هرچند که محصول نهایی تفاوتهایی خواهد داشت ولی این طرح میتواند به عنوان مدلی برای باتریهای جریانی آینده قلمداد شود. با کج کردن دستگاه به سادگی میتوان میزان برق ورودی به شبکه را کم و زیاد و در ساعات اوج مصرف برق مورد نیاز مصرفکنندگان را تامین کرد.
در یک طرح دیگر، این گروه سولفور را جایگزین وانادیوم کرد. سولفور برخلاف وانادیوم فراوان و ارزان است. سولفور محلول در آب به درون حفرهی مرکزی ریخته و از آن خارج میشود و در نتیجه میتواند انرژی را ذخیره یا آن را آزاد کند. این گروه اکنون در حال کار روی این طراحی و بهبود باتریهای جریانی هستند. ایدهی این باتری اولین بار سال ۲۰۱۴ در نشریهی Nano Letters منتشر شد.
چالش دیگر در توسعهی باتریهای جریانی یافتن راهی برای محدود کردن مواد فعال است تا در مخازن خودشان باقی بمانند. این کار بر عهدهی غشاء است با این حال از آنجا که مولکولهای ارگانیک مورد نظر برای استفاده در باتری همیشه خیلی کوچک هستند، میتوانند به راحتی از درون غشاء رد شوند و عمر باتری و عملکرد آن را کاهش دهند.
نوع باتری: سدیم-سولفور
چگونگی کارکرد: یک هستهی مذاب سدیم از طریق یک سد الکترولیت جامد، یونها را با سولفور جابجا میکند.
مورد استفاده: ذخیرهی کلان انرژی الکتریکی (ذخیرهی انرژی الکتریکی بادی یا خورشیدی)
مزایا: ارزان و فراوان بودن مواد و طول عمر زیاد.
موانع: باید در دمای بالا کار کند و بنابراین نمیتوان از آن در خودروهای برقی استفاده کرد.
گروهی به رهبری «ژاکن رودریگز لوپز» (Jaoquin Rodriguez-Lopez) از دانشگاه ایلینوی به جای تغییر نوع غشاء، راههایی برای جمعآوری مواد فعال باتری از طریق تغییر اندازه و پیکربندی آنها ابداع کرده است. این دانشمندان دهها میلیون مولکول فعال را به یکدیگر پیوند دادند تا ساختارهای بزرگ و حلقوی، ریسمانهای بلند مولکولهایی که به یک محور پلیمری وصل شدهاند یا ترکیبی از پلیمرها با میلیاردها مولکول بسازند. آنها سال ۲۰۱۴در نشریهی Journal of the American Chemical Society نتیجهی این پژوهش را منتشر کردند.
کِرَبتری میگوید که در صورت بوجود آمدن مولکولهای بزرگ، «غشاهای ساده، ارزان و متخلخل در جلوگیری از تبادل مولکولها موثر واقع میشوند.» به نظر میرسد که در سال جاری مدلی پیشتولید از یک باتری جریانی ساخته شود که ارزان است و میتواند ۲۰ تا ۳۰ سال عمر کند.
استفاده از هوا
اگر به آیندهای دورتر نگاه کنیم، دانشمندان به دنبال ساخت باتریهایی هستند که مواد به کار رفته در آنها فوقالعاده ارزان یا اصلا کاملا بدون هزینه است. باتریهای لیتیوم-هوا که اکنون در مراحل اولیهی توسعه هستند از اکسیژن هوا برای ایجاد واکنشهای تولیدکنندهی جریان برق استفاده میکنند. در این فرایند اکسیژن با یونهای لیتیوم ترکیب میشود تا یک ترکیب جامد به نام لیتیوم-پروکسید بوجود آید. به هنگام شارژ شدن باتری، اکسیژن جامد به حالت گازی در میآید.
نوع باتری: لیتیوم-هوا
چگونگی کارکرد: مولکولهای اکسیژن از هوا با یونهای لیتیوم در آند واکنش میدهند و انرژی آزاد میشود. به هنگام شارژ هم اتمهای اکسیژن جدا و لیتیوم دوباره آماده به کار میشود.
مورد استفاده: خودروها
مزایا: میتوان باتریهای خیلی سبکوزن ساخت.
موانع: یافتن الکترولیتهایی که با اجزاء دیگر واکنش نميدهند چالشبرانگیز است. باتریها طول عمر خیلی کمی دارند و باید تدابیری برای ایمنی آنها اندیشه شود.
یک مهندس مواد در دانشگاه MIT به نام «جو لی» (Ju Li) میگوید: «لیتیوم-هوا بالقوه بیشترین تراکم انرژی ممکن را ارائه میدهد.» او اینطور ادامه میدهد: «خیلی ساده فلز لیتیوم را با اکسیژن هوا وارد برهمکنش میکنید و به صورت نظری میتوانید به اندازهی بنزین از آن انرژی بگیرید.»
البته باتریهای لیتیوم-هوا هم مشکلاتی دارند. شارژ کردن دوبارهی این باتریها سخت است و طی این فرایند بیشتر توان خود را از دست میدهند. همچنین واکنش شیمیایی که باعث کارکرد باتری میشود گرما تولید میکند و در نتیجه ظرفیت ذخیرهی انرژی و طول عمر آن کاهش مییابد.
لی و گروهش با استفاده از میکروسکوپهای الکترونی واکنشهای شیمیایی، مدلی پیشساخته از باتری لیتیوم-هوا را زیر نظر گرفتند و به یک راهحل احتمالی برای حل مشکلات رسیدند. اینکه اکسیژن را به شکل جامد در یک باتری مهر و موم شده به دام بیندازید و از تبدیل شدن آن به حالت گازی جلوگیری کنید. بدین ترتیب آنها توانستند یک باتری کاملا عایق شده بسازند. این استراتژی جدید که نتیجهی آن ۲۵ جولای ۲۰۱۶ در نشریهی Nature Energy چاپ شد باعث محدود کردن اتلاف انرژی به هنگام شارژ دوباره و جلوگیری از افزایش دما میشود.
لی میگوید: «اگر این در مقیاس کلان هم کار کند ما میتوانیم وسیلهی نقلیهای بسازیم که کاملا با خودروهای بنزینی رقابت میکند.» رسیدن به این هدف گام بزرگی در جهت داشتن یک سیارهی سبزتر است.
دیجی کالا مگ